Tổng hợp lý thuyết chương Đại cương cứng về hóa học hữu cơ
Tài liệu Tổng hợp định hướng chương Đại cương cứng về hóa học hữu cơ Hoá học tập lớp 11 đang tóm tắt kiến thức và kỹ năng trọng vai trung phong về chương Đại cương về hóa học hữu cơ từ đó giúp học viên ôn tập để núm vứng kiến thức môn Hoá học tập lớp 11.
Bạn đang xem: Tổng hợp kiến thức hóa hữu cơ lớp 11

Lý thuyết mở màn về chất hóa học hữu cơ
I. Hợp hóa học hữu cơ với hóa học hữu cơ
1. Khái niệm
- Hợp hóa học hữu cơ là những hợp hóa học của C trừ oxit của C, muối bột cacbua, muối hạt cacbonat, muối bột xianua.
- Hoá học tập hữu cơ là ngành hóa học chuyên phân tích các hợp chất hữu cơ.
2. Phân loại hợp chất hữu cơ.
Hợp chất hữu cơ được phân chia thành hidrcacbon và dẫn xuất hidrcacbon.
a/ Hidrcacbon là loại hợp chất hữu cơ đơn giản nhất, trong thành phần phân tử chỉ chứa hai nguyên tố là cacbon và hidro.
- Hidrocacbon mạch hở:
+ Hidrocacbon no: Ankan CH4
+ Hidrocacbon ko no có một nối đôi: Anken C2H4
+ Hidrcacbon ko no có nhị nối đôi: Ankadien
- Hidrocacbon mạch vòng:
+ Hidrocacbon no: xicloankan
+ Hidrocacbon mạch vòng: Aren
b/ Dẫn xuất của hidrocacbon là những hợp chất mà trong phân tử ngoài C, H ra còn có một số giỏi nhiều nguyên tố khác như O, N, S, halogen...
- Dẫn xuất halogen: R – X ( R là gốc hidrocacbon)
- Hợp chất chứa nhóm chức:
- OH - : ancol; - O - : ete; - COOH: axit......
3/ Đặc điểm chung
- Hợp hóa học hữu cơ nhất thiết đề nghị chứa C, hay bao gồm H thường gặp mặt O hình như còn tất cả halogen, N, P...
- links chủ yếu trong hợp chất hữu cơ là links cộng hóa trị.
- các hợp chất hữu cơ thường sẽ dễ bay hơi, dễ cháy, kém bền nhiệt.
- những phản ứng vào hoá học tập hữu cơ thường chậm, không trả toàn, xảy ra theo rất nhiều hướng thường bắt buộc đun rét và có xúc tác.
4/ Các cách thức tinh chế hợp hóa học hữu cơ
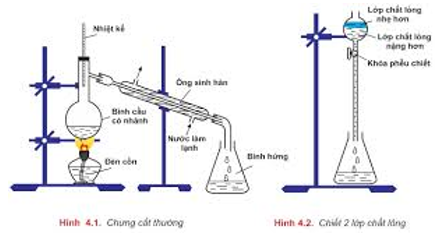
- bác bỏ cất: để tách bóc các chất lỏng có ánh sáng sôi khác biệt nhiều.
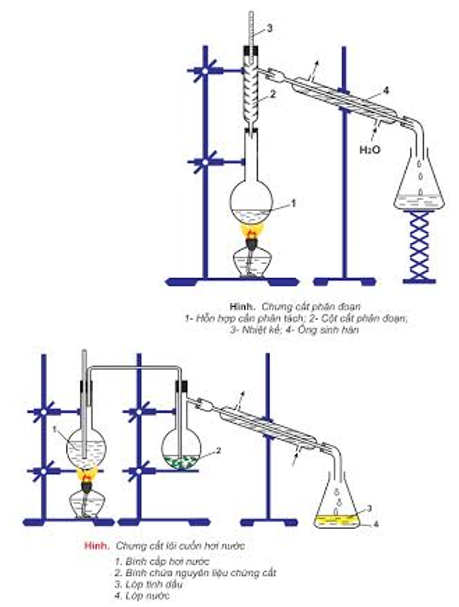
- Chiết: để tách bóc hai hóa học lỏng không xáo trộn vào nhau.
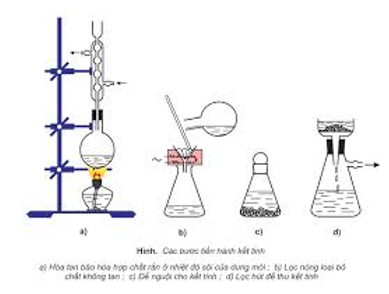
- Kết tinh lại: để bóc các hóa học rắn có độ tan không giống nhau theo sức nóng độ.
II. Phân tích nguyên tố
Để xác định công thức phân tử hợp chất hữu cơ người ta phải xác định :
- Thành phần định tính nguyên tố.
- Thành phần định lượng nguyên tố.
- Xác định khối lượng phân tử.
1. Phân tích định tính nguyên tố.
- Phân tích định tính nguyên tố để xác định thành phần các nguyên tố hóa học chứa vào một chất.
- Muốn xác định thành phần các nguyên tố , người ta chuyển các nguyên tồ trong hợp chất hữu cơ thành các hợp chất vô cơ đối chọi giản rồi nhận ra các sản phẩm đó.
a. Xác định cacbon và hidro.
- Nhận Cacbon: Đốt cháy hợp chất hữu cơ:
C −+O2→ CO2 −+Ca(OH)2→ CaCO3
- Nhận Hidro: Đốt cháy hợp chất hữu cơ:
2H −+O2→ H2O −+CuSO4 khan→ CuSO4.5H2O ( màu xanh lam)
- Hoặc có thể dùng chất hút nước mạnh như : H2SO4 đđ, CaCl2 khan, P2O5.
b. Xác định nitơ và oxi.
- Nhận N: Đốt cháy hợp chất hữu cơ, nếu có mùi khét thì hợp chất đó có nitơ.Hoặc đun hợp chất hữu cơ với H2SO4 đặc ( NaOH đặc) có mùi khai NH3 thì hợp chất đó có chứa nitơ.
CxHyOzNt −+ H2SO4đ, tº→ (NH4)2SO4+......
(NH4)2SO4 + 2NaOH −tº→ Na2SO4 + H2O + NH3↑
- Nhận O : Khó phân tích định tính trực tiếp, thường xác định nhờ định lượng:
mO = mhợp chất – tổng khối lượng các nguyên tố
c. Xác định halogen.
khi đốt cháy hợp chất hữu cơ chứa clo bị phân hủy, clo tách ra dưới dạng HCl, ta dùng dung dịch AgNO3
HCl + AgNO3 → AgCl↓ + HNO3
2. Phân tích định lượng các nguyên tố:
- Phân tích định lượng các nguyên tố xác định khối lượng của mỗi nguyên tố hóa học chứa trong hợp chất hữu cơ.
- Muốn định lượng nguyên tố, người ta chuyển các nguyên tố trong hợp chất hữu cơ thành các hợp chất vô cơ 1-1 giản, định lượng chúng, từ đó suy ra khối lượng từng nguyên tố có trong một chất.
a. Định lượng cacbon và hidro.
VD: Đốt cháy chất hữu cơ A thu được CO2 và H2O và N2
mC (A) = mC(CO2) = nCO2.12
mH(A) = mH(H2O) = nH2O.2
b. Định lượng nitơ
mN(A) = nN2.28
c. Định lượng oxi
mO = m(A) – ( mC + mH + mN ).
* Chú ý :
- Dùng H2SO4 đặc, P2O5, CaCl2 khan hấp thụ H2O.
- Dùng NaOH, KOH, Ca(OH)2 hấp thụ CO2, độ tăng khối lượng của bình xuất xắc khối lượng kết tủa CaCO3 giúp ta tính được CO2
- Chỉ dùng CaO, Ca(OH)2, NaOH hấp thụ sản phẩm gồm CO2 và H2O thì khối lượng bình tăng chính là tổng khối lượng CO2 và H2O.
3. Thành phần nguyên tố:
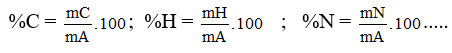
Lý thuyết công thức phân tử hợp chất hữu cơ
I. Công thức dễ dàng nhất
1. Công thức dễ dàng và đơn giản nhất (CTĐGN)
- cho biết số nguyên tử của những nguyên tố trong phân tử.
cho biết thêm tỉ lệ dễ dàng nhất giữa số nguyên tử của các nguyên tố vào phân tử.
Ví dụ: CTĐGN của etilen (CH2)n, của glucozo (CH2O)n (với n là số nguyên dương, chưa xác định).
2. Cách thiết lập cấu hình CTĐGN
đúng theo chất chứa C, H, O bao gồm dạng CxHyOz.
* Để lập CTĐGN ta lập:
x : y : z = nC : nH : nO
= mC/12 : mH/1 : mO/16
= %(m)C/12 : %(m)H/1 : %(m)O/16
Sau đó biến đổi thành tỷ lệ tối giản.
II. Thiết lập cấu hình công thức phân tử
1. Xác định khối lượng mol phân tử
- Đối với chất khí và hóa học lỏng dễ hóa hơi, fan ta xác định trọng lượng mol phân tử nhờ vào tỉ khối của chúng (ở thể khí) so với hóa học khí sẽ biết theo công thức:
MA = MB.dA/B; MA = 29.DA/kk
- Đối với chất rắn và hóa học lỏng khó hóa hơi, tín đồ ta đo độ tăng nhiệt độ sôi của dung dịch so với dung môi và tính được trọng lượng mol phân tử của hóa học tan không phai hơi, không hóa học điện li.
2. Thiết lập công thức phân tử (CTPT)
cho biết thêm số nguyên tử của mỗi nguyên tố trong một phần tử phù hợp chất.
Ví dụ: CTPT của etilen C2H4, glucozo C6H12O6, benzen C6H6. Tương tác với CTĐGN làm việc trên, thông số n đối với etilen: n = 2, với glucozo n = 6.
* quan hệ giữa CTPT và CTĐGN:
- Số nguyên tử của các nguyên tố trong CTPT là số nguyên lần trong CTĐGN.
- trong vô số nhiều trường hợp, CTĐGN chính là CTPT.
- một số trong những chất bao gồm CTPT không giống nhau, nhưng tất cả cùng CTĐGN.
Xem thêm: Tin Thể Thao Hôm Nay, Tin Thể Thao Nhanh 24/7 Mới, Tin Thể Thao, Bóng Đá, Kết Quả, Lịch Thi Đấu
* giải pháp lập CTPT hợp chất hữu cơ:
a. Dựa vào thành phần phần trăm cân nặng các nguyên tố
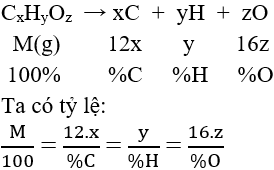
b. Thông qua CTĐGN
từ bỏ CTĐGN ta bao gồm CTPT là (CTĐGN)n.
Để xác minh giá trị n ta dựa vào trọng lượng mol phân tử M.
c. Tính thẳng theo trọng lượng sản phẩm cháy

Lý thuyết kết cấu phân tử hợp chất hữu cơ
I. Thuyết kết cấu hóa học
1. Nội dung thuyết cấu tạo hóa học
- trong phân tử hợp hóa học hữu cơ, những nguyên tử link với nhau theo đúng hóa trị cùng theo một lắp thêm tự tuyệt nhất định. Vật dụng tự links đó call là kết cấu hóa học. Sự thay đổi thứ tự links đó, tức là chuyển đổi cấu tạo thành hóa học, sẽ tạo nên ra hợp hóa học khác.
Ví dụ: bí quyết phân tử C2H6O gồm hai công thức kết cấu (thứ tự link khác nhau) ứng cùng với 2 hợp chất sau:
H3C−O−CH3: đimetyl ete, chất khí, không chức năng với Na.
H3C−CH2−O−H: ancol etylic, chất lỏng, công dụng với Na hóa giải hiđro.
- vào phân tử hợp chất hữu cơ, cacbon có hóa trị 4. Nguyên tử cacbon không những rất có thể liên kết cùng với nguyên tử các nguyên tố khác cơ mà còn links với nhau thành mạch cacbon.
Ví dụ:
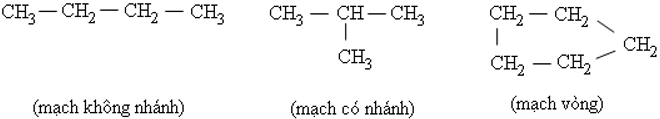
- Tính chất của những chất phụ thuộc vào yếu tố phân tử (bản chất, con số các nguyên tử) và cấu tạo hóa học tập (thứ từ bỏ liên kết những nguyên tử).
Ví dụ:
- phụ thuộc thành phần phân tử: CH4 là chất khí dễ dàng cháy, CCl4 là chất lỏng không cháy; CH3Cl là hóa học khí ko có tác dụng gây mê, còn CHCl3 là hóa học lỏng có chức năng gây mê.
- Phụ thuộc kết cấu hóa học: CH3CH2OH với CH3OCH3 khác nhau cả về tính chất hóa học.
2. Đồng đẳng đồng phân
a. Đồng đẳng
- Đồng đẳng là hiện tại tượng các chất hữu cơ có kết cấu và đặc điểm hóa học giống như nhau nhưng lại thành phần phân tử khác biệt một hay các nhóm CH2.
- những chất thuộc thuộc dãy đồng đẳng đúng theo thành một dãy đồng đẳng có công thức chung.
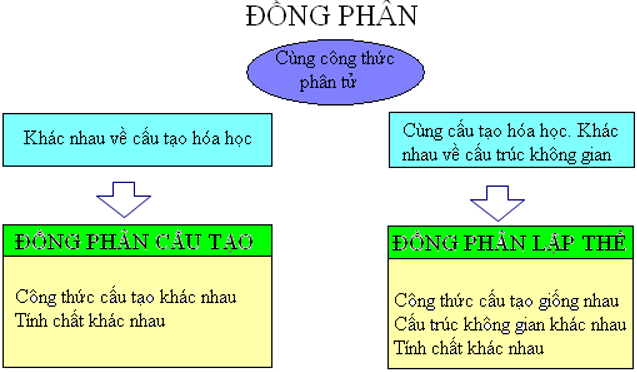
b. Đồng phân
- Đồng phân là những chất hữu cơ gồm cùng cách làm phân tử nhưng cấu trúc khác nhau nên đặc thù hóa học tập khác nhau.
- Cần chú ý phân biệt đồng phân kết cấu và đồng phân lập thể (đồng phân cis – trans).
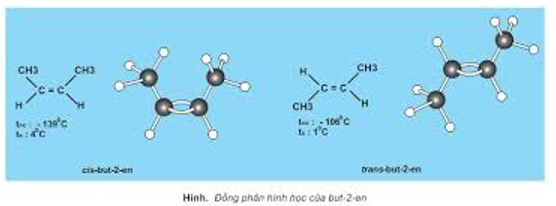
II. Liên kết trong phân tử hợp hóa học hữu cơ
1. Những loại link trong phân tử hợp chất hữu cơ
- liên kết thường chạm mặt trong hợp chất hữu cơ là liên kết CHT, gồm links σ và link π.
- Sự tổng hợp của links σ cùng π chế tác thành links đôi hoặc tía (liên kết bội).
a. Link đơn (σ)
- do một cặp electron chế tạo ra thành, được màn trình diễn bằng 1 gạch nối thân 2 nguyên tử.
- links σ bền.
b. Links đôi (1 σ và 1 π)
- vày 2 cặp electron sinh sản thành, được màn trình diễn bằng 2 gạch ốp nối thân 2 nguyên tử.
- gồm 1σ bền cùng 1 π kém bền.
c. Liên kết ba (1 σ với 2 π)
- vì chưng 3 cặp electron tạo thành thành, được màn trình diễn bằng 3 gạch ốp nối thân 2 nguyên tử.
- tất cả 1σ bền cùng 2 π hèn bền.
* những liên kết đôi và ba gọi là links bội.
- khi nguyên tử cacbon tham gia links đơn, những obitan nguyên tử hóa trị lai hóa hình dạng sp3 (lai hóa tứ diện đều). Góc lai 109’28”.
- lúc nguyên tử cacbon tham gia liên kết đôi, các obitan nguyên tử hóa trị lai hóa hình dạng sp2 (lai hóa đều). Góc lai hóa 120º. Ví dụ: Phân tử C2H4.
- lúc nguyên tử cacbon tham gia link 3, những obitan nguyên tử hóa trị lai hóa mẫu mã sp (lai hóa mặt đường thẳng). Góc lai hóa 180º. Ví dụ: Phân tử C2H2.
2. Các loại bí quyết cấu tạo
cho biết thêm trật từ bỏ liên kết của các nguyên tử trong phân tử. Lúc viết CTCT bắt buộc nhất thiết bảo đảm đúng hóa trị của những nguyên tố. Rất có thể viết CTCT bên dưới dạng khá đầy đủ và rút gọn.
- công thức khai triển: màn biểu diễn trên khía cạnh phẳng giấy tất cả các links giữa những nguyên tử.
- cách làm CT thu gọn:
* những nguyên tử hoặc nhóm nguyên tử cùng link với một nguyên tử C được viết thành 1 nhóm.
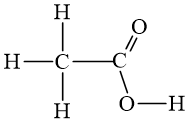
* Hoặc chỉ biểu diễn liên kết giữa các nguyên tử C với với team chức (mỗi đầu đoạn trực tiếp hoặc điểm cấp khúc là một trong cacbon, ko biếu thị số nguyên tử H links với cacbon).
Ví dụ: Viết công thức cấu tạo của axit axetic.
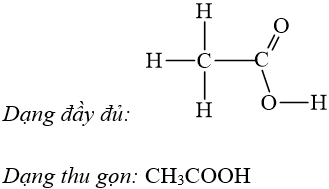
III. Đồng phân cấu tạo
1. Có mang đồng phân cấu tạo
Butan−1−ol cùng đietylete có cùng phương pháp phân tử C4H10O tuy vậy do khác nhau về cấu trúc hóa học tập nên khác nhau về đặc điểm vật lí và đặc điểm hóa học.
Vậy phần lớn hợp chất gồm cùng cách làm phân tử tuy nhiên có cấu trúc hóa học khác biệt gọi là số đông đồng phân cấu tạo.
2. Phân loại đồng phân cấu tạo
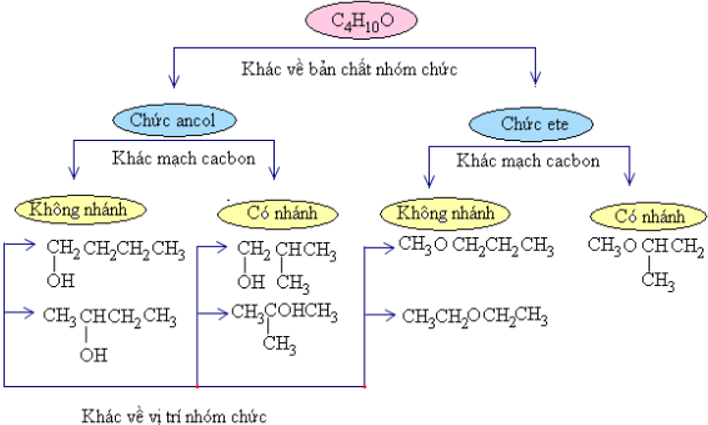
hồ hết đồng phân khác nhau về thực chất nhóm chức call là đồng phân nhóm chức. Mọi đồng phân không giống nhau về sự phân nhánh mạch cacbon hotline là đồng phân mạch cacbon. Phần đông đồng phân không giống nhau về địa điểm nhóm chức gọi là đồng phân vị trí nhóm chức.
IV. Bí quyết biểu diễn cấu trúc không gian phân tử hữu cơ
1. Công thức phối cảnh
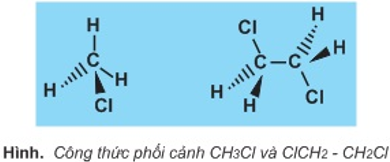
công thức phối cảnh là 1 trong những loại bí quyết lập thể.
Đường nét ngay tức thì biểu diễn liên kết nằm cùng bề mặt trang giấy.
Đường đường nét đậm biểu diễn liên kết hướng về mắt ta (ra phía trước trang giấy).
Đường đường nét đứt biểu diễn links hướng ra xa đôi mắt ta (ra phía đằng sau trang giấy).
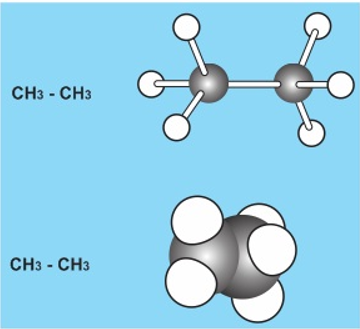
2. Mô hình phân tử
a. Quy mô rỗng
các quả ước tượng trưng cho các nguyên tử, những thanh nối tượng trưng cho các liên kết giữa chúng. Góc giữa hai các thanh nối bởi góc lai hóa.
b. Mô hình đặc
những quả cầu giảm vát tượng trưng cho các nguyên tử được ghép với nhau theo đúng vị trí không gian của chúng.
V. Đồng phân lập thể
1. Tư tưởng về đồng phân lập thể
- Ứng cùng với công thức kết cấu CHCl=CHCl gồm hai cách sắp xếp không gian không giống nhau dẫn tới hai hóa học đồng phân:
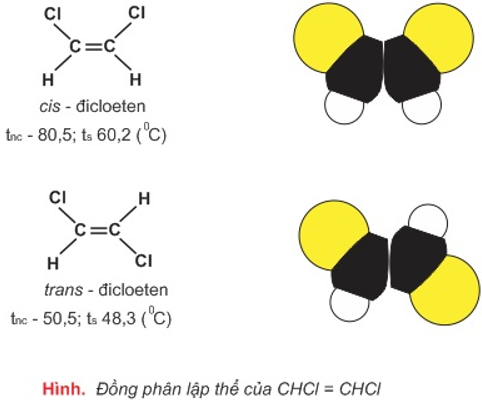
- Kết luận:
- Đồng phân lập thể là phần đa đồng phân có cấu trúc hóa học như sau (cùng cách làm cấu tạo) nhưng khác nhau về sự phân bố không gian của các nguyên tử vào phân tử (tức khác biệt về cấu tạo không gian của phân tử).
2. Dục tình giữa đồng phân kết cấu và đồng phân lập thể
3. Kết cấu hóa học và kết cấu hóa học
- Cấu chế tác hóa học mang lại ta biết các nguyên tử link với nhau theo máy tự nào, bằng link đơn hay link bội, cơ mà không cho thấy thêm sự phân bố trong không khí của chúng. Kết cấu hóa học được biểu diễn bởi công thức cấu tạo.
- kết cấu hóa học và cấu tạo không gian của phân tử thích hợp thành cấu trúc hóa học.
- kết cấu hóa học tập vừa đến biết kết cấu hóa học tập vừa cho biết sự phân bổ trong không khí của những nguyên tử trong phân tử. Cấu tạo hóa học thường xuyên được biểu diễn bởi cách làm lập thể.















